Imunitně-zprostředkovaná anémie (IMHA)
Imunitně-zprostředkovaná anémie je jednou z nejčastějších příčin anémie u malých zvířat. Podstatou onemocnění je destrukce erytrocytů na základě imunitního mechanizmu, jehož příčina může být primární nebo sekundární (např. infekční). Navzdory dobrému povědomí o onemocnění a terapeutických možnostech je mortalita u tohoto onemocnění vyšší než 50 %.
Studie se shodují, že onemocnění se častěji vyskytuje u špringršpanělů, kokršpanělů, pudlů, setrů, kolií a staroanglických ovčáků. Častěji jsou postiženy feny, průměrný věk nástupu je cca 6 let, nicméně může se vyskytovat v kterémkoliv věku.
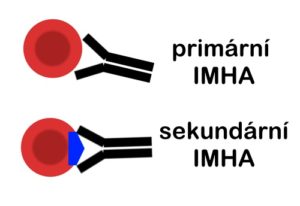
Za normálních okolností jsou stárnoucí erytrocyty fagocytovány monocyto-makroágovým systémem na základě rozpoznání navázaných protilátek proti stárnoucím membránovým proteinům erytrocytů. Při IMHA dochází ke stejnému procesu, navázané protilátky jsou však proti jiným epitopům přítomny na erytrocytu. Na povrch erytrocytů se váží protilátky třídy IgM, IgG nebo IgA, následkem této vazby je pak intra- nebo extravaskulární hemolýza a/nebo aglutinace. Mechanizmem uplatňujícím se v intravaskulární hemolýze je aktivace komplementu, kdy dochází k přímé destrukci erytrocytu a tudíž uvolnění hemoglobinu do krevního řečiště. V komplementem-zprostředkované destrukci jsou efektivnější IgM, tudíž k intravaskulární hemolýze dochází častěji při IMHA s nadprodukcí IgM. Při převaze protilátek typu IgG dochází k destukci erytrocyto monocyto-makrofágovým systémem v játrech a slezině – tudíž k hemolýze extravaskulární a v důsledku následného zpracování hemoglobinu i méně závažné.
Při primární IMHA jsou protilátky namířeny proti vlastním antigenům erytrocytu, nejčastěji proti proteinu glykoforinu. Tyto protilátky se vyskytují u všech jedinců, předpokládá se však, že patologické reakci brání supresorní T-lymfocyty. Rozvojem primární IMHA (= AIHA) je tedy buď nadprodukce autoprotilátek nebo porucha supresorních T-lymfocytů.
Sekundární IMHA je způsobena imunitní reakcí na cizí antigeny které se vyskytují na povrchu erytrocytů. Výčet příčin sekundární IMHA zahrnuje etiologii: infekční (ehrlichie, babesie, anaplasmy, bartonely, leptospiry, dirofilarie, histoplasmozy), neoplazie (lymfom, hemangiosarkom, lymfocytární leukémie, karcinom plic nebo žaludku, jiné difuzní sarkomy), léky (trimetoprim, penicilin, cefalosporiny, levamizol, fenylbutazon, dipyron, chlorpromazin), poruchy erytrocytů (deficit fosfofruktokinázy, pyruvátkinázy, vrozené poruchy fragility), jiné (cibule, česnek, zinek, včelí jed, vakcinace). V některých studiích bylo zjištěno, že čtvrtina pacientů s IMHA byla během posledního měsíce vakcinována (různé vakcíny). Pravděpodobným mechanizmem je zde nespecifická imunologická stimulace. Do skupiny IMHA se řadí také posttransfuzní reakce a neonatální izoerytrolýza.
Diferenciální diagnózy zahrnují neinfekční příčiny IMHA – vrozené defekty (fosfofruktokinázy zejm. u špringršpanělů a kokršpanělů, pyruvátkinázy zejm. u basenji, osmotické fragility zejm. aljašských malamutů a malých kníračů), toxiny (vedoucí k anémii asociované s Heinzovými tělísky), hypofosfatemie (zejm. u diabetické ketoacidózy) a mikroangiopatickou hemolytickou anémii (např. u neoplazií, vaskulitid, onemocnění srdce, DIC).
Nástup klinických příznaků je obvykle pozvolný a až do stádia výrazné anémie kompenzován tachykardií a tachypnoe. V anamnéze se může objevovat kolaps, slabost, intolerance zátěže, únava, anorexie, tachypnoe, dyspnoe, zvracení, průjem a ojediněle Pu/Pd.
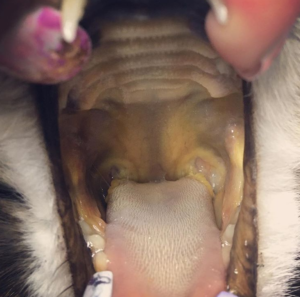
V klinickém vyšetření dominuje bledost sliznic, tachypnoe, kardiovaskulární alterace (tachykardie, S3 gallop, systolický šelest – zejména při poklesu hematokritu pod 20 %), splenomegalie, hepatomegalie, ikterus, pigmenturie, lymfadenopatie nebo horečka.
U přibližně poloviny až dvou třetin pacientů se vyskytuje současná trombocytopenie (Evansův syndrom).
Dále existují vzácné formy IMHA, kdy dochází k aktivaci protilátek při snížené teplotě způsobující agultinaci nebo hemolýzu erytrocytů na periferii. Příležitostně dochází k rozvoji komplikací spojených s tvorbou imunokomplexů – polyartritidy nebo glomerulonefritidy.
Pro další postup je důležité odlišit, zda jde o primární nebo sekundární IMHA. U primární IMHA je potřeba co nejdříve zahájit intenzivní terapii, u sekundární IMHA terapie zpravidla nezabírá úplně, dokud přetrvává vyvolávající agens. Jelikož je identifikace primární příčiny mnohdy náročná a řada IMHA je léčena jako AIHA, je toto pravděpodobně i důvodem již zmíněné vysoké mortality.
Mezi známky IMHA řadíme:
- Anémie s hematokritem nižším než 25-30 %
- Známky hemolýzy – hemoglobinemie, hemoglobinurie
- Známky přítomnosti protilátek proti erytrocytům – autoaglutinace, sférocytóza, pozitivní Coombsův test
- Vyloučení ostatních příčin anémie
- Pozitivní odpověď na imunosupresní terapii
V rámci laboratorního vyšetření je základem celkové hematologické vyšetření s počtem retikulocytů. Typická je přítomnost anémie regenerativní. Anémie může být různého stupně od mírné po těžkou. Nápomocné je vyšetření krevního nátěru, kde jsou patrné známky regenerace – retikulocytóza, polychromazie, anizocytóza nebo jaderné erytrocyty.
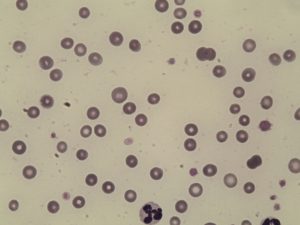
Retikulocyty na panoptickém barvení jsou větší než erytrocyty, bazofilnější, a chybí jim centrální projasnění. Pro jejich vizualizaci se používá barvení novou metylenovou modří nebo briliantkrezylovou modří. Po natření nátěru se počítá počet retikulocytů na 1000 erytrocytů pro získání procenta retikulocytů a následně absolutního počtu. Pro hodnocení vlastní regenerace existuje několik parametrů, které jsou posuzovány:
- Absolutní počet retikulocytů
- Korigované procento retikulocytů
- Retikulocytární produkční index
Sférocyty jsou menší než erytrocyty, chybí jim centrální projasnění a jsou u psů považovány za patognomické pro IMHA, jelikož jsou považovány za erytrocyty, které unikli fagocytóze. U koček se jejich přítomnost nehodnotí, jelikož vzhledem k velikosti kočičích erytrocytů je absence centrálního projasnění fyziologická. Sférocyty se vyskytují přibližně u 90 % psů s IMHA.
Aglutinační test s fyziologickým roztokem je pozitivní u 40-80 % psů. Za autoaglutinaci jsou obvykle odpovědné IgM protilátky, avšak může být způsobena i kvanty IgG protilátek. V případě, že je množství aglutinačních protilátek nízké, je možné je detekovat pomocí Coombsova testu, jehož senzitivita je 60-90 %. Metodou volby je přímý Coombsův test, jelikož je cílem detekovat protilátky na erytrocytu. Třetina pacientů s IMHA bude mít Coombsův test negativní a u pacientů s pozitivní aglutinací s fyziologickým roztokem je test zbytečný.
Mezi další laboratorní nálezy u psů s IMHA patří leukocytóza, která může mít až charakter leukemoidní reakce a některé studie uvádějí, že koreluje s mírou hypoxického tkáňového poškození. Dále hyperbilirubinemie, zvýšení ALT a laboratorní nálezy související s DIC.
V současnosti existuje více možností terapie IMHA, všechny mají za cíl snížit tvorbu protilátek nebo snižují clearance opsonizovaných erytrocytů nebo jejich lýzu komplementem. Poločas rozpadu IgG protilátek je přibližně týden a proto terapie směrující ke snížení tvorby protilátek nemusí být tak efektivní v akutní fázi.
I když je v současnosti větší výběr imunosupresní terapie, nezdá se, že by tato signifikantně snižovala množství nepřeživších pacientů. Příčinou úmrtí je neresponzivnost na terapii, tromboembolie, sepse, reakce na antitrombotickou terapii nebo transfuzi. Cílem terapie je indukce remise a její přetrvávání a prevence a management relapsu.
V rámci terapie je možné uplatnit několik látek:[restrict]
- Glukokortikoidy – jejich hlavní okamžitý účinek u IMHA spočívá v potlačení komplementového systému a fagocytózy opsonizovaných erytrocytů. Obyvkle se podává od dávky 2mg/kg BID pro psy do 6 kg po 1,1 mg/kg BID u psů nad 30kg; i když existuje řada protokolů a dávkování v závislosti na váze, plemeni, kondici, konkurenčních onemocněních a gastrointestinálních příznacích. Za remisi považujeme stabilní nebo zvyšující se hematokrit bez příznaků tkáňové hypoxie během 1-2 týdnů. Dle závažnosti vedlejších účinků snižujeme dávku o 25-50 % a následně o 25 % každé dva týdny. Při dosažení dávky 0,5 mg/kg můžeme podávat prednison obden. Pokud pacient netrpí nežádoucími účinky terapie, je vhodnější ponechat pokles dávky každé 4-6 týdnů místo dvou. Terapii můžeme ukončit, pokud pacient nemá klinické příznaky během 4-6 týdnů na dávce 0,25 mg/kg obden. Samozřejmostí je kontrola krevního obrazu před každou změnou dávky. Nevýhodou terapie glukokortikoidy je rozvoj iatrogenního hyperadrenkorticizmu, ulcerace GIT, rekurentní infekce, sepse, tromboembolie. Nekteří upřednostňují aplikaci dexametazonu, avšak u něho je incidence GIT komplikací a pankreatitidy vyšší, navíc se z hlediska mechanismu účinku nehodí pro podávání obden. Vzhledem k mechanismu účinku jsou GC vhodná terapie indukce.
- Lidský i.v. imunoglobulin (hIVIg) – je sterilní purifikovaný humánní IgG, předpokládá se, že má antiidiotypickou aktivitu, inhibici tvorby protilátek, urychlení rozpadu protilátek, suprese komplementu, inhibice fagocytózy. Podávají se v dávce 0,5-2 g/kg rozdělené do dávek dva dni po sobě v intervalu 6-12 hodin. hIVIg se zdá být úspěšný u některých refrakterních, zejména neregenerativních IMHA. Doposud není dostatek dat pro hodnocení dlouhodobé aplikace, zdá se, že benefity jsou zejména v indukční fázi a při opakované aplikaci je nutné zvážit riziko alergické reakce. Nevýhodou použití je i cena preparátu.
- Danazol – androgenový derivát používaný jako doplňková terapie zejména IMT. Za mechanizmus účinku se považuje inhibice fagocytózy, dávka je 10-15 mg/kg SID. Nevýhodou může být dramatické zvýšení hmotnosti, hepatotoxicita a cena.
- Splenektomie – vhodná pro refrakterní případy nebo případy vyžadující dlouhodobou medikaci vysokých dávek nebo v případě relapsů. Slezina je místem destrukce zejména IgG opsonizovaných erytrocytů a je pravděpodobné, že benefit splenektomie nebude výrazný u IgM autoprotilátek, kterých hlavním místem clearance jsou Kupfferovy buňky v játrech.
- Cyklofosfamid – jedná se o cytotoxické myelosupresivní agens, toxické pro dělící se i nedělící se buňky. Má schopnost suprese buněčné a humorální imunity a suprimuje mononukleární fagocytární funkci. I když existují studie popisující výhody jeho použití, na základě prospektivních studií nelze jeho použití při terapii doporučit.
- Azatioprin – je cyklický antimetabolit inhibující buněčnou proliferaci s menším množstvím nežádoucích reakcí oproti cyklofosfamidu. Snižuje aktivaci a proliferaci lymfocytů vedoucí ke snížené tvorbě protilátek, nástup účinku trvá cca 2-4 týdny. Doporučená dávka je 2 mg/kg SID 5-7 dní, následně 2 mg/kg obden. I když neexistuje optimální protokol, někteří autoři doporučují velmi pozvolné vyřazování, např. přidávání dne bez medikace mezi medikacemi po každých 4 týdnech. Mezi nežádoucí účinky azatioprinu patří poruchy GIT a myelosuprese, která má však dobrou prognózu pokud nedojde k myelofibróze. Z tohoto důvodu se pravidelně monitoruje krevní obraz medikovaných pacientů.
- Cyklosporin A – cyklický polypeptid, metabolit Tolypocladium inflatum s výrazným imunosupresním působením inhibujícím tvorbu cytokinů a aktivaci T-lymfocytů. Zatím není dostatek prospektivních studií hodnotících benefity použití cyklosporinu, zdá se však, že ho lze doporučit k terapii prednisonem zejména u těžších případů IMHA. Dávka je přibližně 5-10 mg/kg SID s monitoringem plazmatické hladiny o cca 400-500 ng/ml. Medikace cyklosporinem může být spojena s řadou nežádoucích účinků včetně ojedinělých malignit, navíc jeho cena a nutnost monitoringu terapie snižuje možnost využití.
- Mykofenolát mofetil – fermentační produkt penicilinů, který inhibuje enzym v syntéze purinů. Výsledkem je inhibice proliferace lymfocytů a diferenciaci aloreaktivních cytotoxických T lymfocytů. Nežádoucí účinky jsou zejména GIT projevy, pro terapii IMHA u psů zatím chybí klinické studie.
- Leflunomid – syntetický isoaxzolový derivát metabolizovaný v játrech a GIT. Leflunomid suprimuje aktivované T a B lymfocyty a snižuje tvorbu protilátek a prozánětových cytokinů. Vzhledem k malému množství studií ve veterinární medicíně nejsou známy vedlejší účinky.
- Plazmaferéza – obecně je plazmaferéza jednou z možností terapie autoimunitních onemocnění, zejména z důvodu eliminace protilátek z plasmy, nicméně ve veterinární medicíně zatím chybí dostatek studií hodnotící její využití u zvířat s IMHA.
Relaps IMHA je relativně častý a týká se 10-20 % případů. U psů s akutním relapsem je nutná agresivní intenzivní terapie složena z aplikace prednisonu a u závažných případů hIVIg, splenektomii a plazmaferézu. Pokud jde o mírný relaps, je pouze možné navýšit glukokoritokoidy např. na předchozí dávku. Vždy je nutné odlišit relaps od vedlejších účinků terapie (např. krvácení do GIT).
Zdroj: 10.1080/01652176.2011.604979, Balch a Mackin A. Compend Contin Educ Vet. 2007 Apr;29(4):217-25.[/restrict]
